宿主细胞残留蛋白
宿主细胞残留蛋白(Host Cell Protein,HCP)是指宿主细胞生产或者编码产生的非目标蛋白聚合。作为工艺过程相关杂质,其残留含量通常被认为是产品的关键质量属性(CQA),其残留量使处在较低水平上,也可能引发机体未知的免疫应答而影响生物制品的功效。
各国药典及药品监督管理局对于HCP控制均有相应要求和指导:美国药典USP1132章节中规定应用一种灵敏度较高的方法检测HCP,HCP的残留量应该控制在100ppm以下;2020年版中国药典三部各论中指出,CHO细胞残留蛋白占总蛋白含量要保持在0.05%以下。基于酶联免疫吸附 (ELISA)方法操作简便快速、高灵敏、高通量等特点各国药典法规推荐使用ELISA方法检测HCP。
宿主细胞残留蛋白ELISA检测法的问题和挑战
虽然ELISA方法是各国药典推荐的生物制品HCP检测的首选方法,但由于ELISA方法的局限性以及HCPs复合组分等特点,采用ELISA方法检测HCP也存在诸多问题和挑战:
1、ELISA是总含量检测方法,故而无法鉴别和分析HCPs的种类及丰度,尤其是无法对单个高风险蛋白进行鉴别和定量分析。如需要对HCPs进行种类鉴定分析则需要结合质谱等方法充分研究。
2、HCPs是复合组分,而非单一蛋白,并非每个HCP蛋白都能产业有效的检测抗体。故而采用ELISA多抗的检测方法会存在漏检的风险。需要评估检测方法抗体对于样本中HCP种类的覆盖率。一定程度上覆盖率越高,能被抗体识别的HCPs种类越多,漏检的风险和影响就越小。
3、相比普通HCP,一些具有较强酶活性或免疫原性等特征的高风险蛋白(如PLBL2)越来越收到监管机构和行业的关注,对于此类HCPs如果漏检而无法监控其工艺去除情况和残留限度,则可能存在较大的药品安全风险。故而需要评估检测方法抗体对于高风险蛋白的识别和检出能力。

表1. 文献报道的CHO宿主细胞常见高风险HCP举例
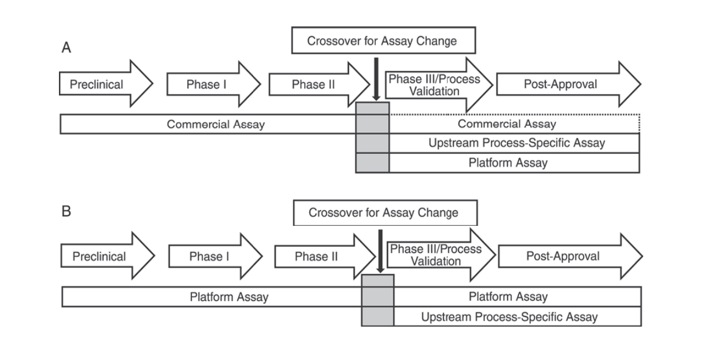
4、ELISA检测方法是相对定量方法,需要通过参考品的标曲进行计算。而参考品中HCPs的组成和丰度与实际工艺样本中的HCP的组成和丰度的差异会影响检测结果,目前也没有HCP标准品统一尺度。为减少此类差异建议企业参考药典指南建议,如USP<1132>,在临床III期及BLA阶段,需要考虑细胞类型及工艺特异性等因素,开发平台专属试剂盒或产品/工艺专属试剂盒。
图1. USP <1132>章节关于不同阶段使用HCP试剂盒类型的建议
针对目前宿主细胞残留蛋白ELISA检测方法存在的问题,依科赛自主研发出支持申报的高覆盖HCP检测试剂盒,包含ResiQuant®CHO宿主蛋白残留检测试剂盒、ResiQuant®E.coli宿主蛋白残留检测试剂盒、ResiQuant®293宿主蛋白残留检测试剂盒。抗体覆盖率均达到80%以上,尽可能减少漏检风险,且试剂盒均经过设计优化,满足多种复杂基质情况的检测需求,并通过系统性方法学性能验证。

也恭喜我们的客户浙江博锐生物和北京益科思特生物采用ResiQuant®CHO宿主蛋白残留检测试剂盒进行放行检测的项目成功获得IND批件。

产品特点

1、灵敏度高:CHO HCP检测试剂盒定量下限可达1ng/mL;
2、定量范围广:293 HCP检测试剂盒定量范围10~1000ng/mL;
3、抗体覆盖率高:抗体覆盖率均可达80%以上;

图2.ResiQuant® HEK293 HCP检测试剂盒抗体
覆盖率验证数据(覆盖率88%)
4、能识别高风险蛋白:对于已有文献报道的高风险蛋白均能大部分识别检测;

表2. ResiQuant® CHO HCP检测试剂盒
可覆盖检测的高风险蛋白(仅部分展示)
5、制备工艺具有代表性:选用具有代表性的细胞株或菌株,模拟相关生物制品实际表达工艺(如质粒生产的碱裂工艺)制备校准品和抗原;检测方法特异性更高;
6、供应链安全:批间批内稳定性高,供货稳定充足避免抗体频繁换批。

定制化HCP试剂盒开发服务

依科赛生物拥有专业的技术团队和丰富的试剂盒开发经验,可以提供针对特定宿主细胞与生产工艺的定制化HCP检测试剂盒开发服务:从抗原选择分析及制备,标准品赋值溯源到全分子HCP免疫制备高覆盖率抗体及体系优化,定制开发产品/工艺专属HCP检测试剂盒或平台型HCP检测试剂盒,满足法规对于不同阶段HCP检测的要求。同时也可以提供基于AAE-MS等技术平台的抗体覆盖率验证服务。

HCP检测产品信息


相关产品