作者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。

邦尔骨科医院集团完成超8亿人民币Pre-IPO轮融资
行业视角:
邦尔骨科目前旗下控股运营17家医疗机构,分布5省16城,其中16家医院以二级或三级标准设置,1家互联网医院,可开放总床位数超过5,000张,年手术量超过40,000台,旗下医院均是以创伤骨科、脊柱外科、关节外科、运动医学、手足显微外科、颈肩腰腿痛非手术治疗中心、中医骨伤科和康复科为特色的专科医院和综合医院。
优抵生物完成近1亿人民币首轮融资
行业视角:
优抵生物由行业领先、经验丰富的团队引领,基于全球领先的Simoa®数字化单分子免疫检测技术平台引进与本土化有机结合而成立。Simoa技术可实现真正单分子水平的数字化超敏免疫检测,依托其达到飞克级别的检测灵敏度,能够准确检测到外周血样本中极为痕量的 AD 生物标志物,可将诊断窗口期提前。
粒影生物完成数千万人民币Pre-A+轮融资
行业视角:
粒影生物已经搭建完善五大技术平台用于蛋白改造,已助力50余种高难度蛋白原料的开发。公司基于胶原蛋白三螺旋形成的分子机制,解决行业内关键技术难点,在不到半年的时间内已经在大肠杆菌、酵母、哺乳动物细胞等多种表达体系实现了多种类型三螺旋胶原蛋白的表达纯化,且可实现在高温下保证三螺旋结构的稳定存在。
西弥斯医疗完成数千万人民币A轮融资
行业视角:
西弥斯医疗聚焦医美赛道并率先提出医美“诊疗”结合理念,让医疗美容实现从传统经验式治疗向精准治疗的跨越。主要产品覆盖超声、射频、光学、皮肤检测等完整的医美科室解决方案。创始团队均来自国内外头部医疗器械公司,具有十余年丰富的医疗美容产品研发、营销及生产管理经验。
启灏医疗完成数千万人民币C轮融资
行业视角:
启灏医疗自2017年成立以来,一直致力于耳鼻喉科赛道的产品研发、生产、销售。目前已成功研发出五种具有核心竞争力的耳鼻喉科产品。其中公司核心国家创新产品——可降解膨胀止血绵已于今年上半年取得注册证,并已正式投产入院使用。
睿璟生物完成数千万人民币Pre-B轮融资
行业视角:
睿璟生物团队多年深耕中美两地肿瘤IVD行业,深刻洞察中美差距并结合中国临床真实需求,在中国落地了甲状腺癌全流程解决方案。公司于2023年8月,斩获国内甲状腺结节基因检测第一证,成功填补了甲状腺结节术前诊断产品的空白;同时睿璟生物也在积极布局新癌种的检测。
墨卓生物完成数千万人民币Pre-B轮融资
行业视角:
墨卓生物已形成高通量单细胞多组学测序、微生物单细胞测序、单细胞分选等多种平台型产品线,提供集仪器、芯片、试剂、生信软件于一体的整体解决方案。墨卓生物核心产品MobiNova®-100高通量单细胞建库系统,打破了持续多年的国内单细胞测序工具进口垄断局面,产品已服务于全国各院校、研究所及企业。
Elucid完成8,000万美元C轮融资
行业视角:
公司核心产品ElucidVivo是一款新型非侵入性软件,其采用独特的AI技术(PlaqueIQ)来为医生提供经济高效的方法以优化心血管疾病患者的治疗决策。PlaqueIQ基于数千个组织样本的组织学检查,客观地量化动脉斑块的范围和稳定性,为患者提供量身定制化的护理。
科源制药收购诺康达12%股份
行业视角:
北京诺康达医药是一家以辅料研究为基础、制剂技术为核心的CRO服务企业,可为合作伙伴提供药品(仿制药和新药)、医疗器械、特医食品,临床前药学研究、临床研究、注册申报、上市后再评价等全链条的研发服务,具有私人订制、高效专业、国内国际同步开发的特点。2023年7月,诺康达创业板首发申请未能过会。


11月10日晚间,国家组织高值医用耗材联合采购办公室发布《国家组织人工晶体类及运动医学类医用耗材集中带量采购公告(第2号)》(国耗联采字〔2023〕1号),涉及9类耗材品种,含31个产品类别,将于11月30日(周四)于天津开标。
信息来源:医疗器械创新网

减重针剂礼来替尔泊肽正式在FDA获批减重适应症 和黄医药/武田「呋喹替尼」获美国FDA批准上市 海和药物MET抑制剂拟纳入突破性治疗品种 武田创新酶替代疗法获FDA批准 合源生物CAR-T产品「纳基奥仑赛」在中国获批 唯柯医疗D-shant心房分流器获FDA突破性认证 多款医疗器械产品获批上市


司美格鲁肽17,600例三期临床成功
诺华潜在“best-in-class”抑制剂双项关键3期试验达主要终点
TIGIT靶向抗体疗法临床2期研究的A1队列初步结果公布
安斯泰来新机制眼科药物3期试验积极
圣诺医药公布STP705用于局部减脂的积极临床数据
全球首款仿生型可组装式左心耳封堵器SimuLock首例入组
Vesalio的NeVa血栓切除术设备在CLEAR研究中的评估结果
Penumbra公布Indigo抽吸系统最新临床研究结果

司美格鲁肽17,600例三期临床成功
11月11日,诺和诺德在AHA会议上公布司美格鲁肽2.4mg剂量心血管获益三期临床SELECT最新数据,数据同步发表在新英格兰医学期刊(NEJM)上。SELECT入组17,604例有既往心血管疾病肥胖/超重患者,随机分配接受司美格鲁肽或安慰剂治疗。司美格鲁肽组569例心血管死亡或非致病性stroke事件,对照组701例,心血管风险降低20%。
信息来源:医药笔记
诺华潜在“best-in-class”抑制剂双项关键3期试验达主要终点
诺华公布关键3期REMIX-1和REMIX-2试验的最新积极数据,这两项试验评估其在研布鲁顿酪氨酸激酶(BTK)抑制剂remibrutinib在H1抗组胺药不能充分控制症状的慢性自发性荨麻疹(CSU)患者中的疗效。分析显示,与安慰剂相比,remibrutinib表现出具有临床意义和统计学显著性的荨麻疹症状减轻。
信息来源:药明康德
TIGIT靶向抗体疗法临床2期研究的A1队列初步结果公布
近日,吉利德科学和Arcus Biosciences公司联合公布EDGE-Gastric临床2期研究的A1队列初步结果,分析证明TIGIT靶向抗体domvanalimab PD-1靶向抗体zimberelimab和化疗联合治疗局部晚期无法切除或转移性胃、胃食管连接部或食管腺癌患者展现积极的总缓解率(ORR)达80%,并且这一效果不受患者肿瘤的PD-L1表达水平影响。
信息来源:药明康德
安斯泰来新机制眼科药物3期试验积极
安斯泰来发布了GATHER2第三阶段临床试验的最新成果,分析显示,其产品avacincaptad pegol(商品名:Izervay)的玻璃体内注射液在连续两年内有效延缓了因年龄相关性黄斑变性(AMD)引起的地图状萎缩(GA)在患者中的进展速度。
信息来源:药明康德
圣诺医药公布STP705用于局部减脂的积极临床数据
近日,圣诺医药在今年度举行的秋季临床皮肤病学会议上,展示了RNAi药物STP705用于减少局部脂肪(Focal Fat Reduction)的积极临床数据。该报告探讨了STP705在接受腹部整形术的患者中的安全性和耐受性,同时对STP705诱导脂肪细胞凋亡减少脂肪的疗效进行了初步观察。
信息来源:细胞基因治疗前沿
全球首款仿生型可组装式左心耳封堵器SimuLock首例入组
11月8日,复旦大学附属中山医院葛均波院士带领周达新教授和团队完成全球首款仿生型且可组装式左心耳封堵器SimuLock的前瞻性、多中心、随机对照确证临床试验的全国首例入组和成功植入,标志着这项由葛均波院士牵头的SimuLock左心耳封堵器的全国多中心确证临床试验开启全面入组。
信息来源:MedTF
Vesalio的NeVa血栓切除术设备在CLEAR研究中的评估结果
近期,Vesalio公司公布了CLEAR的研究结果,这是FDA批准的一项研究性器械豁免研究,旨在评估该公司的NeVa血栓清除平台在治疗急性缺血性卒中方面的安全性和有效性。NeVa取栓支架采用了该公司的Drop Zone技术,可清除血管闭塞性(LVO)卒中的所有类型的血栓。
信息来源:VINNOVA SIGHT
Penumbra公布Indigo抽吸系统最新临床研究结果
最近,Penumbra公司发布了一项STRIKE-PE 数据,评估了 Penumbra 的 Indigo 抽吸系统和 Lightning。结果表明,Penumbra的计算机辅助真空血栓切除术(CAVT)在减轻右心压力方面是安全有效的。
信息来源:思宇MedTech

诚益生物与阿斯利康就小分子GLP-1受体激动剂达成独家合作 普米斯(Biotheus)与BioNTech达成合作 博腾生物与百图生科建立战略合作


邦士医疗上市辅导备案 丽珠试剂分拆终止创业板IPO

邦士医疗上市辅导备案
近日,证监会官网披露,邦士医疗上市辅导备案,辅导机构为华泰联合证券有限责任公司,派出机构为江苏证监局。公司主导产品是拥有发明专利和多项新型实用专利的等离子微创手术系统。
信息来源:医疗器械创新网
丽珠试剂分拆终止创业板IPO
11月10日,丽珠集团发布公告称,董事会同意终止筹划控股子公司“丽珠试剂”分拆创业板上市,并同意“丽珠试剂”申请在新三板挂牌。
信息来源:IVD资讯


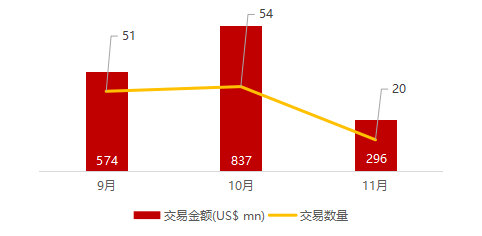





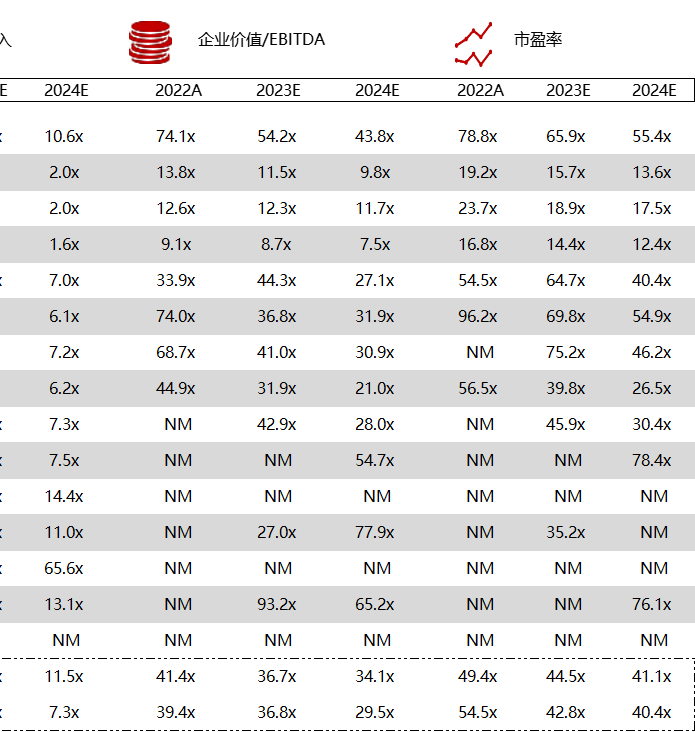
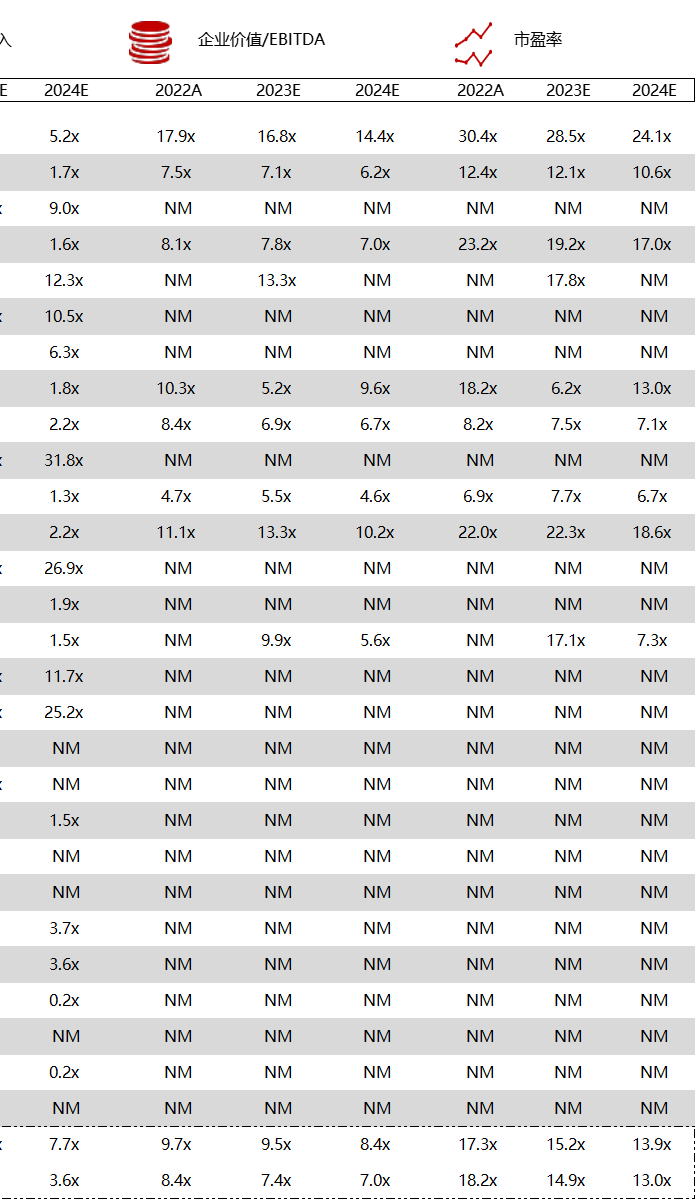
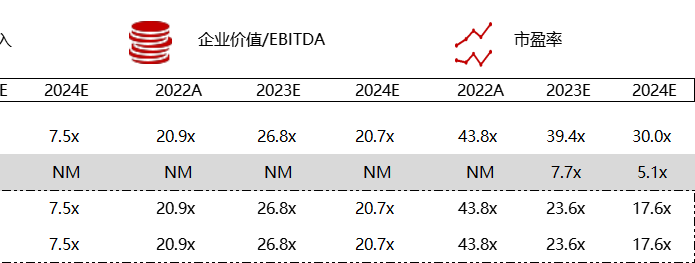
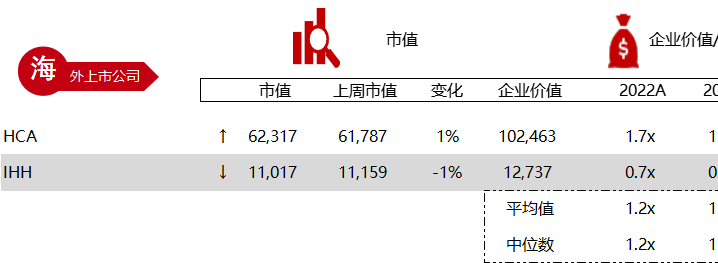
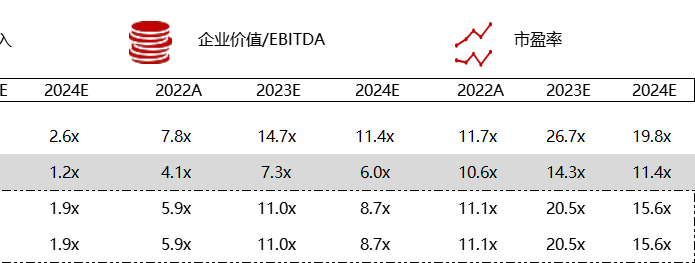
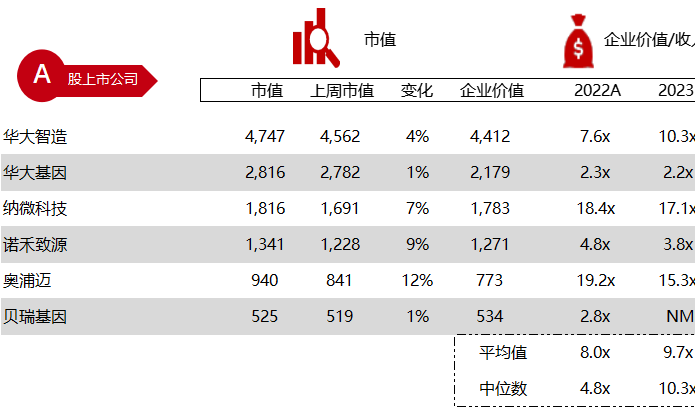
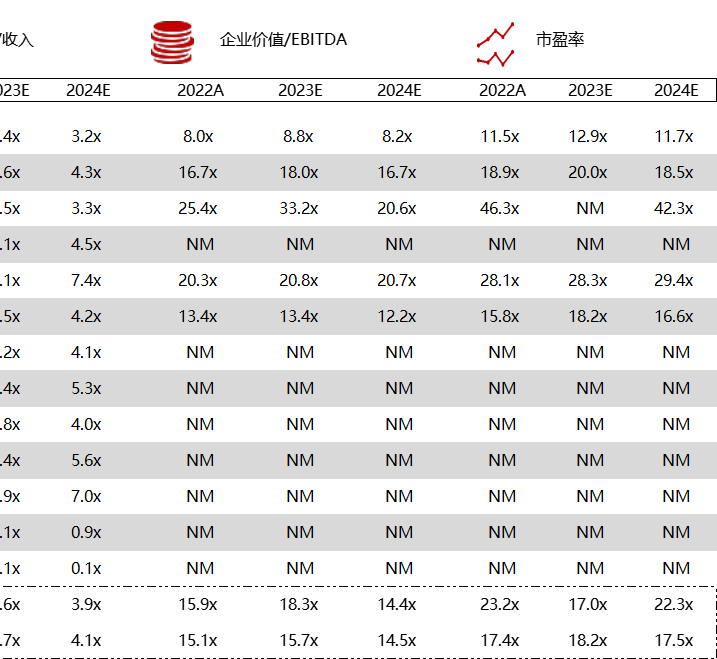
注:境外二级市场指港股及美股

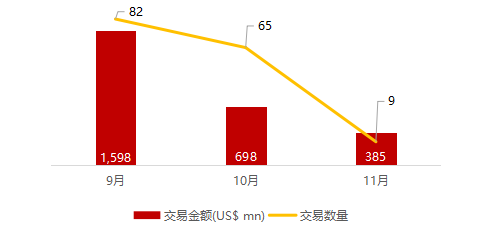





*数据来源:华兴资本内部整理


< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >