
近日,亘喜生物科技集团(纳斯达克:GRCL,以下简称 “亘喜生物”)宣布和龙沙集团(Lonza,SIX:LONN)达成了一项生产服务协议(MSA)。根据协议,龙沙集团将会为亘喜生物在美国生产基于 FasTCAR 平台开发的 CAR-T 细胞疗法临床候选产品。
龙沙集团位于瑞士,是一家拥有逾百年历史的全球制药及化工巨头,其在生物化学、精细化工和功能化学等领域均处于行业领先地位。
截至 2019 年,龙沙集团帮助客户开发并进入上市生产的生物制药,在数量上、成功率上均超越全球任何一家 CDMO,其合作客户包括 BMS、GSK、诺华、赛诺菲等大型制药公司。早在 1995 年,龙沙集团就进入中国市场,先后在广州、南京、上海、苏州投资并设立了生产基地和办事处。
亘喜生物在今年年初登陆纳斯达克,在这之前,其曾一度考虑在港上市,“定位在纳斯达克,在国际资本市场,可能更合适一些,有利于之后与美国研究所和企业合作、license-in 或者并购”,亘喜生物创始人兼 CEO 曹卫曾在媒体采访中表示。
在市场 “摸爬滚打” 的 4 年多时间里,亘喜生物进展迅速,而与龙沙集团的合作是其在 2021 年宣布的首个合作,为其进军国际市场拉开了序幕。
曹卫的 “野心”
用 “野心勃勃” 形容曹卫一点也不为过。
曹卫有超过 30 年的生物技术研发经验,早年担任过哈佛和斯坦福医学院研究员,曾在诺华制药、拜耳和赛默飞世尔科技担任高级科学管理职务,他曾以联合创始人的身份带领细胞治疗公司西比曼于 2015 年登陆纳斯纳克。
之后,曹卫在通和毓承开始了投资生涯,CAR-T 行业的普遍痛点则成为其 “二次创业” 的方向与动力。
自 2017 年成立以来,亘喜生物就在致力于解决自体和同种异体 CAR-T 细胞疗法所面临的挑战,其开发的管线覆盖了白血病、淋巴瘤、骨髓瘤、实体瘤等疾病。
上市之后,亘喜生物也在 3 个月内取得了一系列的里程碑进展。
其用于治疗复发性或难治性 B-ALL 的同种异体 CAR-T 细胞疗法 GC007g 的 I/II 期注册临床研究获中国 NMPA 批准,并入组了首位患者;用于治疗复发性或难治性成人 B-ALL 的 FasTCAR CAR-T 疗法 GC019F 获中国 NMPA 的 IND 批准;与龙沙集团签署协议,在美国生产 FasTCAR 产品候选产品。
基于 FasTCAR 平台技术,亘喜生物能够开发出表型更年轻、耗竭更少、杀伤更佳的自体 CAR-T 细胞产品,能将生产时间从行业传统的 2-6 周大幅缩短至次日完成。
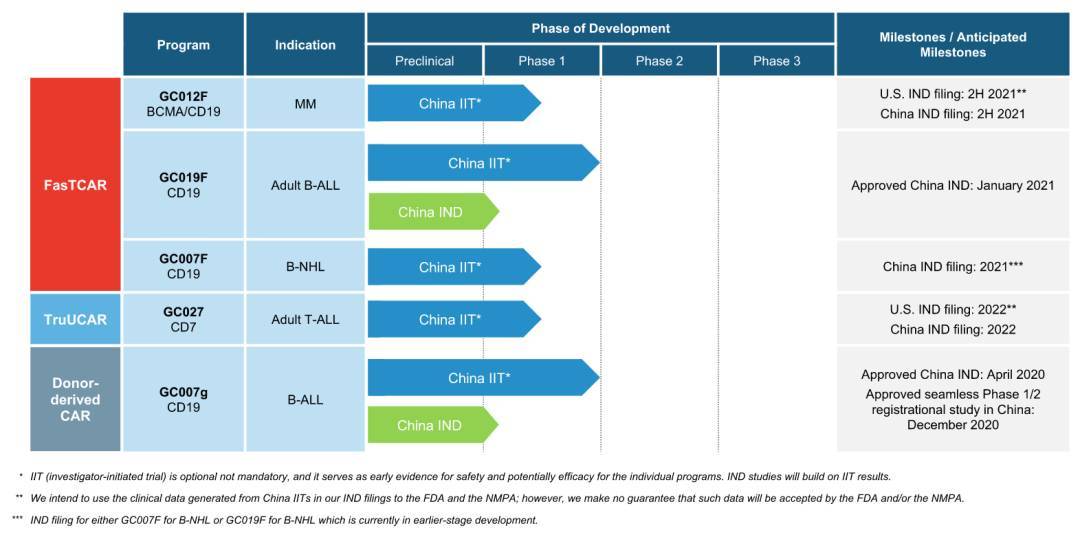
图 | 亘喜生物管线进展(来源:亘喜生物)
曹卫在通稿中这样形容与龙沙集团的合作,“龙沙集团在 CAR-T 疗法生产领域具有丰富的经验和卓越的口碑,是帮助我们将开创性的、自主研发的 FasTCAR 平台技术推向全球的理想合作伙伴”。
“我们正在全球范围内拓展业务,包括开展临床运营,推进多款候选产品的临床开发,希望龙沙集团助力亘喜生物在美国推动新药 IND 申请及临床研究项目的顺利开展”,亘喜生物的首席医学官 Martina Sersch 博士表示。
与龙沙集团的合作似乎是亘喜生物建立国际影响力的第一步。
招股书显示,亘喜生物计划在美国等多个地区建立生产基地,希望将来能够在美国开始运营和临床试验;亘喜生物还计划未来进行收购和战略合作,包括许可、知识产权、技术或者业务等;同时要扩大人员,以及增强开发和制造能力,这意味着需要大量的资金支持。
就在前几日,亘喜生物也发布了 2020 年财报,财报显示,2020 年全年归母净亏损达 2.75 亿元,同比扩大 38%。其中,2020 年全年研发费用达 1.69 亿元,增长费用主要用于临床前研究和临床试验进展。
而对于资金支持,亘喜生物或将通过合作产生。此前,曹卫就在采访中表示,目前有很多企业对于 FastCAR 和 TruUCAR GC027 感兴趣,有可能通过合作产生现金收入。
对于产品上市,曹卫则表示,预计快则两年、慢则三年,公司首个产品可以上市。

中国将很快出现 “走出去” 的公司
以下是生辉此前与曹卫博士的访谈实录整理:
生辉:是什么样的契机让你选择在 2017 年创办亘喜?
曹卫:2017 年之前,中国在 CAR-T 疗法方面的监管和审批还不太成熟,报批途径也不太清晰,政策不明确,为公司融资带来困难,而 CAR-T 的研发需要很多资金投入,在五年前对于初创公司来说很难做到。正好当时我对投资很感兴趣,想在投资行业学习,所以就在 2016 年初从上市公司退了下来,开始做投资。
到 2016 年年底、2017 年年初时,CAR-T 行业出现了很多非常优秀的数据,与以前大不一样,尤其是一些在美国血液学会 (ASH) 上展示的数据,来找我们投资的 CAR-T 项目也变多了,不过这些项目或多或少存在一些不足。行业显露出的机会和正在面对的挑战,让我有了创业的想法:CAR-T 行业本身非常有特色,是有长久生命力的技术,但也存在着成本高的问题,想要让除美国之外的一些市场普遍使用很难。如果我们能通过创新对这些问题进行解决,将是一件非常有价值的事情,所以我就在 2017 年开始了我的实践。
生辉:CAR-T 行业目前面对的难题是什么?亘喜是如何面对的?
曹卫:CAR-T 行业主要面临这几个问题:第一,制备周期长。一般情况下,制备 CAR-T 细胞需要两周时间,为的是获得足够多的细胞。一个患者通常需要几亿至几十亿个 CAR-T 细胞进行治疗,随着患者体重的增长需要的细胞数量越多;第二,成本高。制备周期长连带着成本高。长时间的制备过程中需要消耗大量的易耗品如培养液等,还需要大量人力成本,这些都造成了 CAR-T 的成本高。
面对这些行业问题,亘喜所采取的方式是:技术创新。针对制备周期长的问题,我们自主研发了FasTCARTM,可以将制备周期缩短到一天。我们是如何做到的,FasTCARTM的细胞效率非常高,在体内扩增效率是常规 CAR-T 的几十倍,可以在体内扩增到治疗数量,所以省去了体外扩增的时间。而我们的FasTCARTM细胞在体内扩增之所以能高效,是因为我们在技术手段上进行了突破,提高了基因转导效率,更好地保持细胞年轻态和干性、使其尽量不受耗竭。
针对成本高的问题,我们也进行了有效突破。一方面,扩增阶段的时间缩短,带来了成本的降低。另一方面,我们对病毒工艺进行了改进,提高了病毒载体的效率,也是实现FasTCARTM快速转导的条件之一,同时降低了很多成本。若是进口病毒载体,光是一人份的病毒载体就需要近 5 万美元,这个成本就非常高了。而我们自己制备的高效病毒载体 XLentiTM,让成本大幅降低。当然,提高细胞有效性,缩短细胞体外扩增过程,并不是等比例缩短每一个生产步骤,而是一个技术创新。FasTCARTM技术有国际专利保护。亘喜所带来的创新技术虽然不能叫 “革命”,但可以说做到了 “改变游戏规则”。
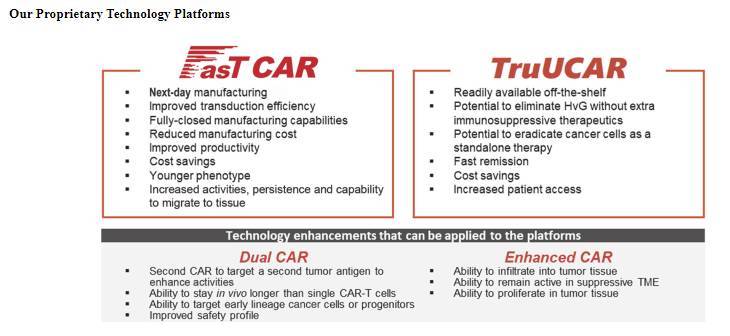
(来源:亘喜生物)
生辉:在通用型 CAR-T 领域,亘喜的优势是什么?
曹卫:我们自主研发的通用型 CAR-T 也是我们独创的技术。当来自异体的通用型 CAR-T 进入人体后,是否能够有效生存和扩增是通用型 CAR-T 行业所面临的最大的一个挑战。与美国 UCAR-T 公司 Allogene 相比,我们采取了不同的方式同样有效控制了 CAR-T 进入人体后的免疫排斥问题。Allogene 公司通过药物辅助,与 Anti-CD52 联用来降低患者的免疫系统对通用型 CAR-T 的免疫排斥。而我们的通用型 CAR-T 不需与其他免疫抑制药物联用,就可以有效控制机体所产生的免疫排异反应。我们利用基因编辑技术对基因进行编辑,去掉 “排异基因”,增加或者加强有利于细胞生存的基因,这是我们的技术创新。
我们在美国癌症研究协会 (AACR) 上通过大会发言的形式展示了五个病人的数据。这五个病人体内通用型 CAR-T 的扩增数量很高,比一般自体 CAR-T 在体内的扩增情况还要好一些。我们对 CAR-T 安全性问题也有明确的改善方向。我们对 DualCAR 的抗原结合区、跨膜区以及共刺激因子等整个结构进行了优化,做了大量的体外实验进行验证和挑选。最终筛选出来的 CAR-T 在不影响疗效的前提下,显著提高了安全性。
生辉:亘喜生物的 CAR-T 产品在制备周期和成本上都有非常强的优势,对于同行来说是不是一种挑战?
曹卫:我觉得更多是对 CAR-T 行业的健康发展注入了一个 “强心剂”。因为医疗行业和资本市场对 CAR-T 行业也有一定的担忧。例如,制备周期长、成本高。这与已经批准上市的两款 CAR-T 产品市场销售低于预期是有关系的。去年我听到一个很有意思的说法是:CAR-T 市场上有点冷下来了。不过是一年时间,行业内如果没有好的、大的消息,就会被认为是冷下来了。而今年传奇上市,股价涨得很高,又被认为这个市场热起来了。有些资本没有从生物制药创新研发的规律去看这个行业的发展历史,而是短线的去评估这个行业的发展状况。
我希望我们在技术上的突破能够给投资人一些信心。现在跟我们接触的资本普遍觉得,成本降低了,生产周期也大幅缩短了,CAR-T 又有新的希望了。如果没有这样的新技术出现,那么资本有可能会选择去投其他的项目,CAR-T 行业就会慢慢冷下去。所以从两个角度看,我们新技术的出现对一些有竞争的公司可能不是一个好消息,但是大家可以合作。对于投资人来说,看这个行业会更有信心。
生辉:你认为从 CAR-T 赛道里面跑出来的公司应该具备什么样特质?
曹卫:目前 CAR-T 市场体量逐渐增大,国内报批审批途径越来越规范,劳动市场具备了一定人才,资本市场对这个行业的认识也相对成熟了一些。所以现在应该过了最早期的阶段,但还没有到成熟期。而到了这个阶段,与初期众多资本、公司一拥而上相比发生了很多变化。专业的投资人越来越多,专业的公司也越来越多,行业逐渐有了一些竞品和风向标。所以新入场的 “me-too” CAR-T 公司越来越少,大家或多或少都有一些小创新,但创新的步伐不大。我认为能从这个赛道里跑出来的公司一定是有超强创新能力,给这个行业带来巨大变化的公司。
生辉:中国有机会在 CAR-T 方面赶超国际领先梯队吗?
曹卫:我觉得有机会。对比目前 CAR-T 行业中美市场,中国临床试验的 “量” 已经超过美国,这是很好的一步,但是 “质” 还不够。从长远来看,这个行业还是需要公司有更多的技术含量和快速开发产品的能力,达到市场要求的同时,也能让资本市场的投资有所回报。我觉得中国的细胞基因治疗行业想要引领世界就需要持续创新,而持续创新需要资本和资源的长期投入与支持。
参考资料:
【往期】
穿越血脑屏障哪家强?丨多肽递送siRNA丨纳米颗粒
上市在即!丨独角兽Zymergen丨合成生物学
AI微生物组疗法重大IPO丨Finch丨背后的故事
黄峥辞任拼多多丨投身生命科学丨下一步怎么走?
融资4亿美元!丨斯坦福AI大姐大丨AI药研新纪录

