
中国国家药监局药品审评中心(CDE)最新公示,德琪医药的ATG-010(selinexor)片上市申请已被纳入拟优先审评名单,拟用于治疗复发或难治性多发性骨髓瘤。ATG-010是由Karyopharm Therapeutics研发的一款“first-in-class”口服型选择性SINE化合物,德琪医药拥有该药在包括大中华区、韩国、澳大利亚、新西兰和东盟国家的多个亚太市场的独家开发和商业化权利。公开资料显示,ATG-010被CDE拟纳入优先审评的申请是其在亚太地区提交的第5个新药上市申请。
截图来源:CDE
作为一款SINE化合物,ATG-010可以引起肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化,以及下调细胞浆内多种致癌蛋白水平,并在体外和体内诱导大量实体和血液肿瘤细胞的凋亡,而正常细胞不受影响。已有临床研究表明,ATG-010对多种血液瘤及实体瘤均有明显疗效且安全性可控。
在美国,ATG-010已获FDA批准治疗多种适应症,包括:联合低剂量地塞米松用于治疗难治复发性多发性骨髓瘤患者;作为单药治疗难治复发性弥漫性大B细胞淋巴瘤患者;以及用于联合治疗既往接受过至少一次治疗的多发性骨髓瘤患者。
根据德琪医药日前发布的新闻稿,此前其已在澳大利亚、韩国、新加坡和中国香港地区提交了ATG-010的NDA。ATG-010在中国大陆的上市申请是其在亚太地区的第5个新药上市申请,也是在中国大陆提交的首个SINE系列化合物的新药上市申请。
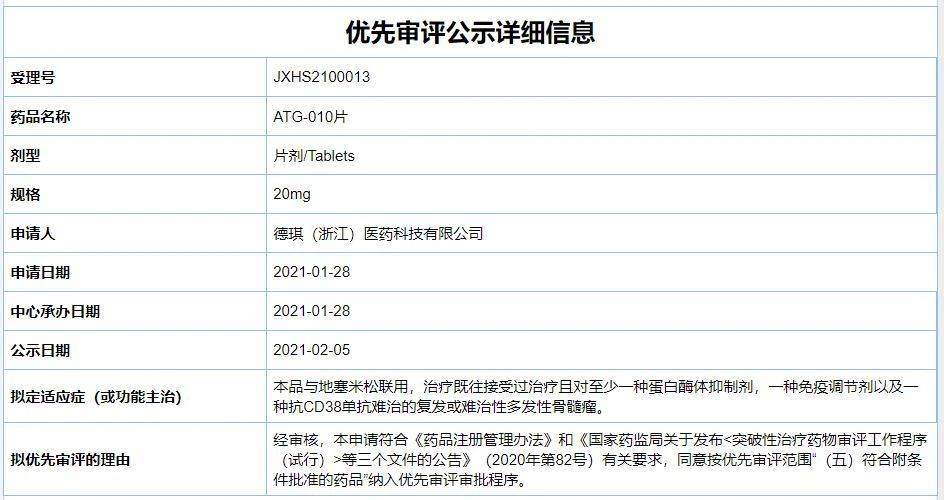
CDE公示信息显示,ATG-010因“符合附条件批准的药品”被纳入拟优先审评程序,针对的适应症为“与地塞米松联用,治疗既往接受过治疗且对至少一种蛋白酶体抑制剂,一种免疫调节剂以及一种抗CD38单抗难治的复发或难治性多发性骨髓瘤”。
截图来源:CDE
ATG-010在美国获批时的数据显示,ATG-010与地塞米松联用在治疗83名复发/难治性多发性骨髓瘤患者中取得了良好的疗效:在这些高度难治的患者中,组合疗法达到25.3%的总缓解率,缓解持续时间为3.8个月。
多发性骨髓瘤是由于骨髓中的浆细胞癌变而导致的血液癌症。异常浆细胞在骨髓中聚集,在身体多处骨骼产生肿瘤。这些细胞不但不能行使正常功能,它们产生的抗体还会导致骨髓无法生成健康的血细胞。虽然目前对多发性骨髓瘤有多种疗法,然而有很多患者仍然会对所有获批疗法都产生抗性,他们迫切需要使用创新机制来控制肿瘤的疗法。
本次ATG-010拟纳入优先审评,标志着中国血液肿瘤患者离这一全新治疗选择更近了一步。期待这款创新疗法早日获批,为患者提供新的治疗选择。
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。

▽关注【药明康德】微信公众号
