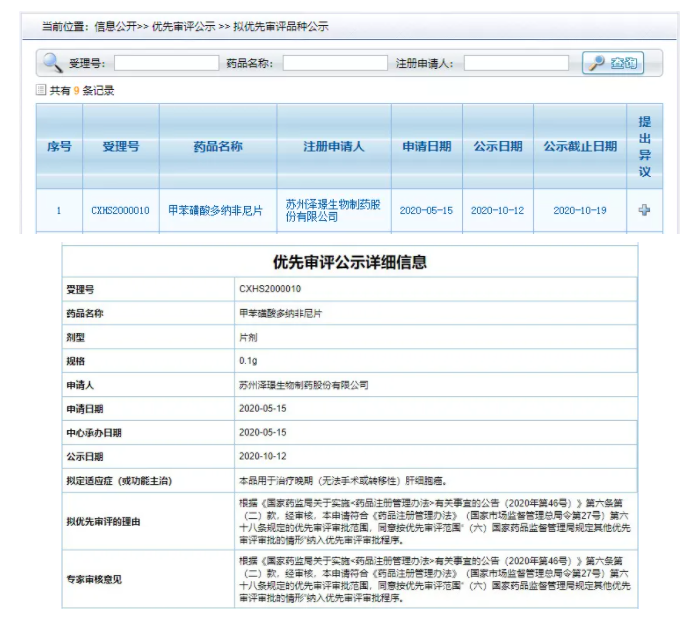

10 月 12 日,CDE 公示拟将泽璟制药 1 类新药「甲苯磺酸多纳非尼片」纳入优先审评审批(受理号:CXHS2000010),用于治疗晚期(无法手术或转移性)肝细胞癌。
甲苯磺酸多纳非尼片是泽璟制药开发的具有自主知识产权的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,属于 1 类新药。
临床前药理学研究证实, 多纳非尼既可抑制 VEGFR、PDGFR 等多种受体酪氨酸激酶的活性,也可直接抑制各种 Raf 激酶,并抑制下游的 Raf/MEK/ERK 信号传导通路,抑制肿瘤细胞增殖和肿瘤血管的形成,发挥多重抑制、多靶点阻断的抗肿瘤作用。
本次拟纳入优先审评的新药上市申请,主要是基于甲苯磺酸多纳非尼片一线治疗晚期肝细胞癌的开放、随机、平行 对照、多中心 Ⅱ/Ⅲ 期临床研究(试验代号 ZGDH3)的结果。ZGDH3 试验是一项 Ⅱ/Ⅲ 期注册临床研究(37 家研究中心同步开展,共纳入了 1:1 随机入组多纳非尼治疗组或索拉非尼对照组。主要终点为总生存期(PFS)、客观缓解率(DCR)、安全性及耐受性等指标。
今年 1 月 1 日,泽璟制药宣布, ZGDH3 研究取得成功,达到预设的主要终点以及安全性结果。在未接受过系统治疗的不可手术或转移性晚期肝细胞癌患者中,多纳非尼治疗组的中位总生存期(mOS)显著优于对照药物索拉非尼治疗组,达到统计学上差异显著性且具有临床意义的延长。
多纳非尼组在 3 级及以上不良事件发生率、与药物相关的导致停药或减量的不良事件发生率等方面显示出更优的安全性。试验中未出现新的或超出预期的重大安全性问题。
有关该项研究的详细数据,已在 2020 年 ASCO 大会上公布(摘要:4506)。
同时,泽璟制药官网显示,多纳非尼治疗肝细胞癌、晚期结直肠癌和碘难治性分化型甲状腺癌的 III 期临床、治疗鼻咽癌的 I 期临床、多纳非尼与抗 PD-1 单抗联合治疗晚期肝细胞癌等多种恶性肿瘤的临床研究正在进行之中。
图片来源:泽璟制药官网
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。
